1.簡介
世界衛生組織(WHO)已於2020年3月11日把COVID-19分類為大流行,根據WHO的網站上在2020年3月22日的資料,已回報了267,013例確診和11,201例死亡個案,而截至2021年11月11日為止則共回報了250,715,502例確診和5,062,106例死亡個案,人們相信COVID-19可以極其快速且幾乎不被查覺地擴散的原因是因為病人即使沒有症狀也可以傳播病毒。反轉錄聚合酶連鎖反應(RT-PCR)似乎是唯一一種能測試是否已感染病毒的方法,然而此法必需在實驗室中進行,是昂貴且是耗時的,因此不能一般性且廣泛性地被使用,而需要其它的方法。
在二十一世紀早期已有人提出「晶片實驗室」的概念:實驗室中的實驗可以在晶片上執行。為了達成此一目標,微陣列(microarray)、微晶片(microchip)、或基因晶片正在發展中,在本文中,我們將介紹在這領域中所應用的基本且重要的概念和結構。在第二章節中介紹生物學背景知識,包含2003年在我國的SARS偵測程序。在第三章節則是介紹此類晶片的基本架構,接下來的二個章節則是分別由微流體和換能器的角度來介紹它們各自的細節。最後,第六章節和第七章節則分別是我國專利現況的簡單分析以及本文的簡短結論。
2.背景知識
2.1 生物學
去氧核糖核酸(DNA)是一種雙股結構,並且是生物學世界的基礎成分之一,每一單股DNA是由四種的鹼基所組成:A(腺嘌呤)、T(胸線密定)、G(鳥嘌呤)、及C(胞密定),其中由於氫鍵數量不同,所以A和G只能分別與T和C相連接。在正向中,DNA從它的3'端至5'端可以被轉錄成核糖核酸(RNA),舉例來說,假如DNA序列的啟動子(promoter)是被啟動則轉錄成初級信使RNA,其中DNA和RNA的差異在於RNA是一種單股結構,其中T被U(尿嘧啶)所取代,然而,並不是在初級信使RNA中的每一鹼基都是有效的,當初級信使RNA中所有內含子被移除而只留外顯子,則可把初級信使RNA剪接成為信使RNA (mRNA),而mRNA中每三個鹼基則被集合成一群,然後該mRNA會被轉譯成為蛋白質[註1]。
2.2 COVID-19 (SARS-CoV-2)
SARS-CoV-2是一種正向單股RNA (+ssRNA)病毒,長度上具有約30,000個鹼基,它有四種已知的結構蛋白質:S(棘蛋白質)、E(封套蛋白質)、M(膜蛋白質)、N(核殼蛋白質),其中棘蛋白質是負責讓病毒可以黏附到宿主細胞的黏膜上[註2]。雖然有數種快速偵測方法在發展中,但最被推薦的方法是反轉錄聚合酶連鎖反應(RT-PCR),在RT-PCR中,首先把一RNA模版(例如來自病人的樣本)用反轉錄酶轉換成互補DNA (cDNA),然後這cDNA被使用為用於使用PCR進行指數放大的模版,在這過程中,一對的引子被使用來選擇將被放大的一特定的連續序列區間。
2.3 2003年我國偵測SARS的RT-PCR步驟
在每一次試測中,一0.2 mL PCR反應管被注入5μL RNA模版、5X緩衝液10μL、dNTP 2μL、酶混合物2μL,並使用corona IN-2 5’-GGGTTGGGACTATCCTAAGTGTGA-3’和corona IN-4 5’-TAACACACAAACACCATCATCA-3’作為引子,而它們全部的反應濃度是0.6μM,該反應管再被注入純水直到體積是50μL為止。再此之後,耗時30分鐘在45°C去進行反轉錄,耗時15分鐘在95°C進行變性,然後進行40次的循環,在每一次循環中,在95°C維持30秒、在50°C維持40秒、在75°C維持1分鐘,最後反應則在72°C維持10分鐘的最終延長中結束,假如在第一次的PCR產物中無法於1.5%洋菜糖凝膠電泳實驗裡觀察到明顯的帶狀物,則會採用不同引子和循環型態進行巢式PCR[註3]。
3. 基因晶片的基本架構
圖1顯示基本的CMOS生醫晶片架構[註4],此處一流體帽蓋被用來容置將被分析的液體,而一CMOS晶片則被用來分析該液體的性質。
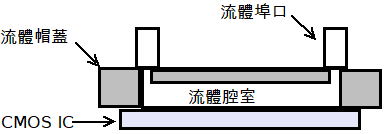
圖1 基本CMOS生醫晶片的架構
因為在流體帽蓋中的流體結構的尺寸是非常地微小,此類流體結構可以被稱為微流體,除此之外,還可以基於是否至少一個移除邊界和微流體所承載的體積,把微流體進一步分為三種類型:開放式、連續流動式、數位流動式。在一些情況中,一種名為微滴式微流體的新類型雖被進一步定義,但在本文的觀點,這種新類型的微流體只是被一些研究人員用來強調流體體積是少量的性質,因此可以被認為是數位式微流體的早期階段,因為一些研究人員使用「數位式微流體」去強調微流體具有動態重新組態的能力。
4.微流體的類型
4.1開放式
在一開放式微流體結構中,待分析的流體是被保留在底部分和四側牆皆被密封的流體單元(例如腔室)中,因此該流體是由空中直接滴入至流體單元裡。這類開放式類型的優點是液體只要良好準備後,即可藉由人工或是機器手臂的控制下被滴入,導致非常高的分析準確率。
4.2連續流動型
開放式微流體的一個缺點在於它們的高操作成本,舉例來說,為了高產量的應用時需要機器手臂。另外一方向,隨著微機電(MEMS)技術的進展,已有人提議密閉式形式的微流體。舉例來說,Kang-Yi Lien等人提議由一微流體控制模組和一預處置/RT-PCR模組所組成的一種微型RT-PCR系統[註6],該微流體控制模組是由二個PDMS基板所形成,並且是由一個雙向S型微唧筒、多個微通道、微閥門、用於樣本載入的腔室、二個預處置/RT-PCR模組、及二個廢物收集器所組成。從另一觀點來說,這個系統含有三個層:頂層是一薄膜層,其主要含有一個雙向S型微唧筒和二個壓縮空氣進氣口;中間層則是另一薄膜PDMS層,裡面建立著多個微流體通道結構、一個樣本載入腔室、及二個清洗腔室;底部層是一玻璃基板,裡面建立一個微線圈結構和一個溫度感測器,以便去分別產生磁場和溫度場,並且去感測溫度分佈。
另外一方向,這個外部壓力機構可以用諸如電滲透的一個電動力機構來取代[註7]。如圖2所示,在二個玻璃基板之間的一個液態三明治形成了一個雙重離子層:一層是接近液態-固態介面的可移動傳播層,另一層則是遠離該介面的一緊密不可移動層。假如一個電場是沿著平行於該液態-固態介面被施加,則在傳播層中的可移動電荷可以移動,然後帶著液體一起移動。
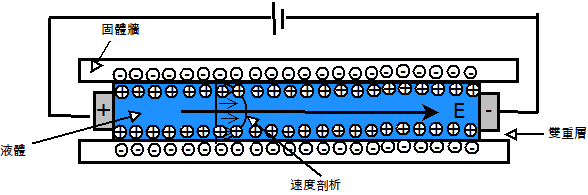
圖2 電滲透結構
這些封閉式通道系統的缺點是它們本質上的難以整合和微小化,因為它們的有些性質是和位置之間有相依性[7]。
4.3 數位式(微滴式)微流體
微滴式微流體的一個特徵是可把液體細分成為一些可以離散可獨立控制的微滴,而已有數種方法被提議來移動基板上的微滴,包含:化學式、聲學式、熱力學式、及電學式方法。化學式和熱力學式的方法的一個共同點是控制沿著通道上的表面張力梯度,舉例來說,在化學式方法中,表面張力梯度可以藉由一電壓控制的電化學反應或是一光敏表面而被產生。
更進一步,表面張力的溫度相依性也在熱力學式方法中使用,壓電表面則在表面聲波(SAW)中使用,然而上面的方法都有要把非標準化CMOS元件整合至晶片上的限制。
另外一方面,電學式方法則是吸引人的,因為它們對於非標準化CMOS元件的需求較少或是不需求,用於電絶緣微滴的介電電泳(DEP)和用於導電微滴的介電濕潤(EWOD)是二種最常用的電學式方法,圖3顯示DEP和EWOD的基本結構。
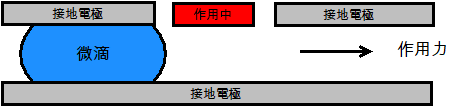
(a)
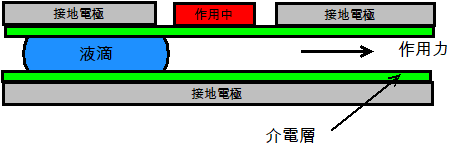
(b)
圖3 數位式微流體的常用電學式結構
(a) DEP;(b) EDOW
在這二種情況中,微滴都是藉由掃掠一外加電壓而沿著微通道被往前運輸。然而在DEP中的粒子不攜戴電荷而必須是可極性化的,所以並不在液體的表面上累積電荷,因此電場穿透進入在DEP中的的液體。相較之下,在EDOW的電極是介電質鍍膜的,以便當電場是用電極建立時,在流體的表面上誘發出電荷累積[註8][註9]。
5. 換能器的類型
5.1 光學式
在一開始,在波長
![]() 公式(1)
公式(1)
其中A是螢光標記的光子吸收量,N是具有
![]() 處放射出一相應的光子通量
處放射出一相應的光子通量


![]() 公式(2)
公式(2)
因此濃度N可以基於該放射光子通量
在傳統的作法中,激發光源和光線接收器是外部裝置,隨著CMOS影像感測器的進展,該外部光線接收器是被一CMOS影像感測器所取代,例如是由Byungchul Jang等人於參考文獻[註10]的圖25.5.3所提議之方式。進一步地,一晶片可能不僅是由CMOS影像感測器(以及它們的相關連電路)所組成,還會包含其它電路零件,舉例來說發光二極體,因此有人提議可以把外部光源和外部光接收器分別都用發光二極體和光偵測器所取代,例如Arun Manickam等人於文獻[註11]圖4中所提議的作法。

圖4 由Arun Manickam等人實施的晶片之橫剖面示意圖
螢光式作法的限制是該光線接收器可能額外接收來自該光源所發射的光,而這光是一種雜訊並對螢光的偵測造成妨礙,因此一濾光片要覆蓋著該光線偵測器,然而假如冷光式的作法是被使用,則這種對於光源和濾光片的要求則可以被省略。
5.2 電分析式
圖5顯示電極-電解液界面的一通用等效電路模型[註12][註13],假設電解液和電極分別是上層和下層,則該電解液-電極界面依序被劃分為溶液層、擴散層、及雙重層。溶液層可以被模型化為一電阻Rs,它的值是取決於在該溶液中多數離子的性質,而不是少數的被分析物分子。該雙重層是被定位於在介於該電極和該電解液之間的界面處,並且可以是被模型化為一個電容器Cdl並聯於一個電阻器Rdl,其中電容器Cdl並不是可忽略的,因為它代表電荷在界面附近累加,相較之下,Rdl的值則是取決於該界面的性質,舉例而言,硫醇化的探針分子可以在金表面上形成一濃密壓縮的單層(monolayer),此一濃密壓縮單層可以防止電荷轉移,而此舉可以被認為是一大的電阻而可以在等效電路中忽略Rdl。最後該擴散層被定位於在該探針處,並且被簡單地模型化為一電容器Cd並聯於一電阻器Rd,而當被分析物被捕獲時,Cd和Rd的值會被改變。因此,可以基於Cd和Rd(可能包含Cdl)的變動而估計算濃度。
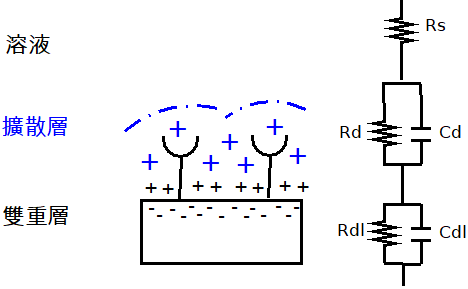
圖5 在電分析式換能器中的等效電路模型
基本上而言,此類變動可以藉由量測電位(電勢法)、阻抗(阻抗波譜法)、及電流(安培偵測法)而被量測,然而據信前面二個方法是相同的,因為是施加一個電壓到該界面並且量測結果電流,相較之下,第三種方法則是調節被施加的電流位準[註12]。因為這些方法有其自己偏好的電流、頻率、及電壓範圍(即應用相同的),所以Arjang Hassibi等人提議一種可組態的拓撲學,如同圖6所示。
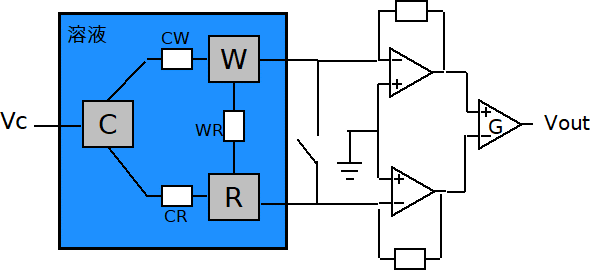
圖6 Arjang Hassibi等人提議之可組態的拓撲學[註12]
其中符號C、W、R分別表示為計數器電極、工作電極、及參考電極,而且工作電極是具有用於捕獲待分析物之探針而被固定不動。當該電路用於阻抗波譜法時,一正弦波電壓是被施加至該計算器電極,而介於該工作電極和參考電極之間的差動電流則被量測,其電路輸入和輸出之間的關係可以被表示為以下公式:
![]() 公式(3)
公式(3)
其中G是輸出放大器增益,

針對電勢法,則是替代地利用一斜坡電壓,並且輸入和輸出間的關係可以被表示為
![]() 公式(4)
公式(4)
其中![]() 和
和![]() 是回應於
是回應於![]() 之分別通過工作電極和參考電極的電流。
之分別通過工作電極和參考電極的電流。
除此之外,假如施加一定電壓,則在工作電極和參考電極之間的法拉第電流差值可以被量測,然而為了解決此種電流差值非常小的問題,由電容器和外部開關形成外部阻抗,使得運算放大器被使用為一積分器,因此輸出電壓可以被寫為
![]() 公式(5)
公式(5)
應注意到,這些電路設計全部都需要三個電極,並且可以根據不同的操作用途來組態。但在一例子中則只需要二個電極,其中一個電極(例如計數器電極)是用於接收輸入訊息,而另一個電極(例如是工作電極)則是接收探針所在處的輸出訊號,然在探針之後的訊號處理/放大電路則是依此進行相應之修改。該探針的輸出訊號用具有90度相差的一對本地信號進行調變,以便產生它們的實數和虛數版本信號[註13],因此,可基於以下公式計算出導納(阻抗的倒數):
![]() 公式(6)
公式(6)
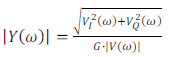 公式(7)
公式(7)
![]() 公式(8)
公式(8)
式中![]() 和
和![]() 是
是![]() 的實數和虛數版本。
的實數和虛數版本。
在一個例子中,當該外部負載是被移除且開關是被關閉以便讓這二個運算放大器不發生作用時,圖6的三個電極可以被操作為一種組態。如同在圖7中所示,離子敏感場效應電晶體(ISFET)和傳統的金屬氧化物半導體場效電晶體(MOSFET)的差異在於MOSFET的閘極電極是被移除,而該絕緣體是暴露於被分析物中[註14]。在一操作組態中,當電壓VDS是被固定時,則汲極電流ID是隨著氫離子濃度而變化;在其它的操作中,可觀察到臨界電壓VT的漂移,而這現象則是取決於該雙重層電容器的電壓低落,舉例來說,Mark J.Milgrew等人提議了一種源極-汲極隨耦器電路去偵查此類VT的漂移[註14]。
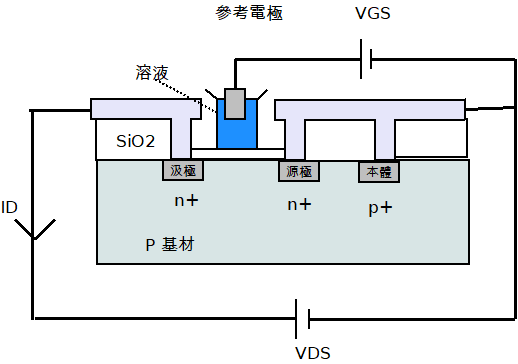
圖7 ISFET結構
6.我國專利現況
由智慧財產局的資料庫顯示,截至2021年11月07日止分別已有488件發明、21件新型已公告之專利裡,在發明名稱、說明書、或申請專利範圍中曾揭露涉及以晶片、積體電路去分析DNA 、RNA等生物物質並具有微流體(microfluidic)、槽道之內容。在這些已公告的發明專利案中,擁有較多專利的第一專利權人依序是國立成功大學(41件)、財團法人工業技術研究院(31件)、國立清華大學(20件)、惠普研發公司(12件)、中央研究院(10件)、台灣積體電路製造股份有限公司(9件)、輝瑞大藥廠(9件)、國立中正大學(8件)、英特爾公司(8件)、國立中興大學(7件)、葛蘭素史密斯克藍生物品公司(7),而前五大於專利權人於各年度中所公告的專利分布則如圖8所示。
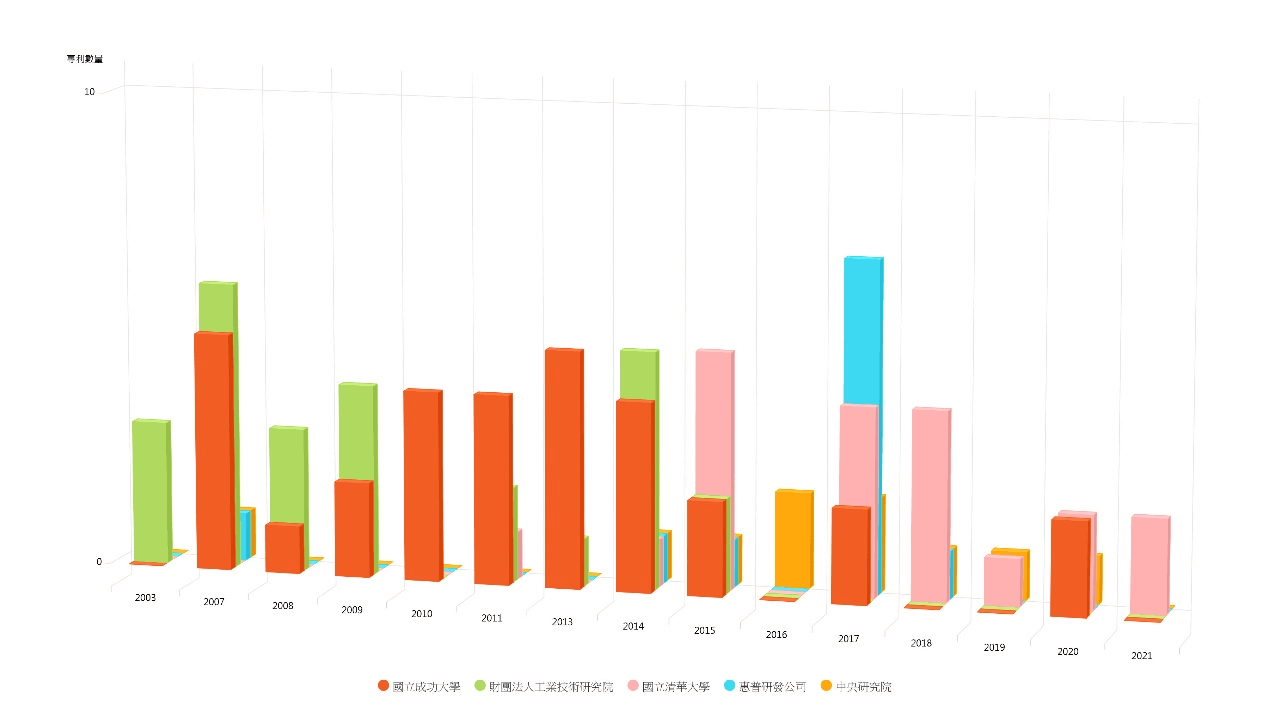
圖8 前五大專利權人之各年度已獲公告之發明專利數
相較之下,在這些已公告的新型專利案中,擁有較多專利的第一專利權人依序是萬金鳳(7件)、來富可得生物科技股份有限公司(5件)、國立成功大學(3 件),而前五大專利權人於各年度中所公告的專利分布則如圖9所示。
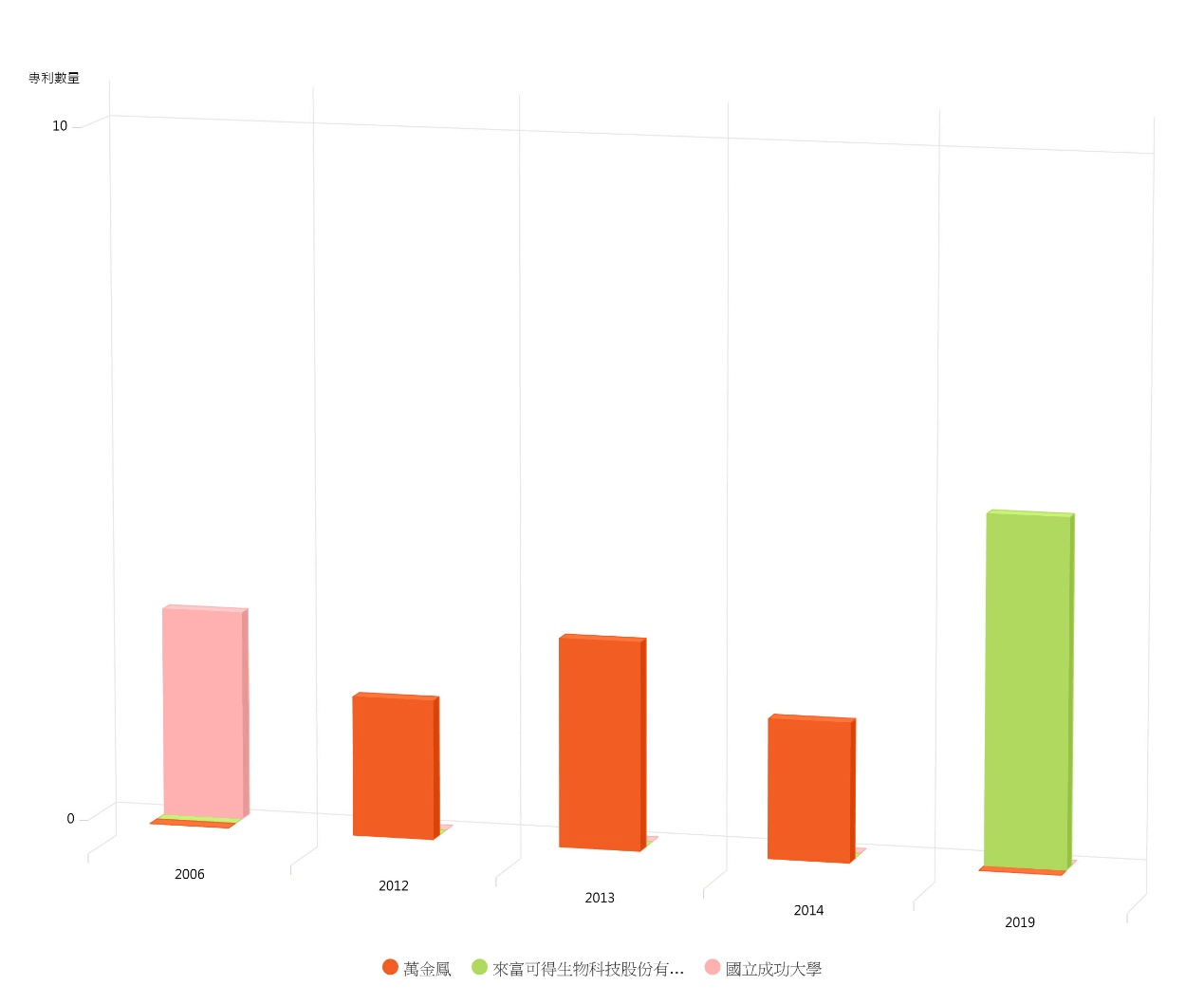
圖9 前三大專利權人之各年度已獲公告之新型專利數
前上述的資料中可以大略地認知到目前從事相關研發之專利權人主要是以學校及研究機構為止,然而亦有相關的廠商業者開始投入,例如惠普研發公司、台灣積體電路製造股份有限公司等,故相關的研究已開始朝商業化邁進。
7.結論
在本文中,介紹了在微流體和換能器中所使用的基本操作方法。而關於換能器的技術議題本質上集中在於如何在標準的IC晶片上進行後處理上,例如部署光學濾光片和生物相容材料(例如金),但隨著CMOS生產製程的進展,相關困難可能會越來越少。相較之下,在微流體中所涉及的問題是複雜的,尤其當數位式微流體是被考慮時。由衷地希望,生醫微晶片或是其它快速、便宜、可攜式偵測方法能在未來中變為商業可能的方案。
參考資料:
註1: 中込彌男著,王海譯, “DNA決定生老病死?!圖解一下!” 書泉出版社, 2010.
註2:Wikipedia, "Severe Acute Respiratory Syndrome Coronavirus 2," Website:https://en.wikipedia.org/wiki/Severe_acute_respiratory_syndrome_coronavirus_2.
註3:林智暉、邱淑君、林永政、王聖帆、楊志元、金芝源、陳宇凡、黃莉芳、陳豪勇,"全球SARS風暴之台灣經驗,"疫情報導, VOL. 19, NO. 6, PP. 306-316, JUNE 2003.
註4: Arjang Hassibi, Nicholas Wood, and Arun Manickam, "CMOS Biochips: Challenges and Opportunities," 2018 IEEE Custom Integrated Circuits Conference, 2018.
註5:Marco Carminati, Roland Thewes, Jacob Rosenstein, and Hoi-Jun Yoo, “Advances and Open Challenges for Integrated Circuits Detecting Bio-Molecules,” 2018 25th IEEE International Conference on Electronics, Circuits and Systems (ICECS), PP. 857-860, 2018.
註6:Kang-Yi Lien, Wang-Ying Lin, Yu-Fang Lee, Chih-Hao Wang, Huan-Yao Lei, and Gwo-Bin Lee, "Microfluidic Systems Integrated With a Sample Pretreatment Device for Fast Nucleic-Acid Amplification," JOURNAL OF MICROELECTROMECHANICAL SYSTEMS, VOL. 17, NO. 2, PP. 288-301, APRIL 2008.
註7: Fei Su, Krishnendu Chakrabarty, and Richard B. Fair, "Microfluidics-Based Biochips: Technology Issues, Implementation Platforms, and Design-Automation Challenges," IEEE TRANSACTIONS ON COMPUTER-AIDED DESIGN OF INTEGRATED CIRCUITS AND SYSTEMS, VOL. 25, NO. 2, PP. 211-223, FEBRUARY 2006.
註8: Patrick M. Young and Kamran Mohseni, "Calculation of DEP and EWOD Forces for Application in Digital Microfluidics," Journal of Fluids Engineering, Vol. 130, AUGUST 2008.
註9: Haoqing Zhang, Honglong Chang,and Pavel Neuzil, "DEP-on-a-Chip: Dielectrophoresis Applied to Microfluidic Platforms," Micromachines, 2019.
註10: Byungchul Jang, Peiyan Cao, Aaron Chevalier, Andrew Ellington, and Arjang Hassibi, "A CMOS Fluorescent-Based Biosensor Microarray," 2009 IEEE International Solid-State Circuits Conference, PP. 435-437, 2009.
註11: Arun Manickam, Rituraj Singh, Mark W. McDermott, Nicholas Wood, Sara Bolouki, Pejman Naraghi-Arani, Kirsten A. Johnson, Robert G. Kuimelis, Gary Schoolnik, and Arjang Hassibi, "A Fully Integrated CMOS Fluorescence Biochip for DNA and RNA Testing," IEEE JOURNAL OF SOLID-STATE CIRCUITS, VOL. 52, NO. 11, PP. 2857-2870, NOVEMBER 2017.
註12: Arjang Hassibi, and Thomas H. Lee,"A Programmable 0.18-µm CMOS Electrochemical Sensor Microarray for Biomolecular Detection," IEEE SENSORS JOURNAL, VOL. 6, NO. 6, PP. 1380-1388, DECEMBER 2006.
註13: Arun Manickam, Aaron Chevalier, Mark McDermott, Andrew D. Ellington, and Arjang Hassibi, "A CMOS Electrochemical Impedance Spectroscopy (EIS) Biosensor Array," IEEE TRANSACTIONS ON BIOMEDICAL CIRCUITS AND SYSTEMS, VOL. 4, NO. 6, PP. 379-390, DECEMBER 2010.
註14:Mark J. Milgrew, Mathis O. Riehle, David R. S. Cumming, "A 16×16 CMOS Proton Camera Array for Direct Extracellular Imaging of Hydrogen-Ion Activity," 2008 IEEE International Solid-State Circuits Conference, PP. 589-591, 2008.









